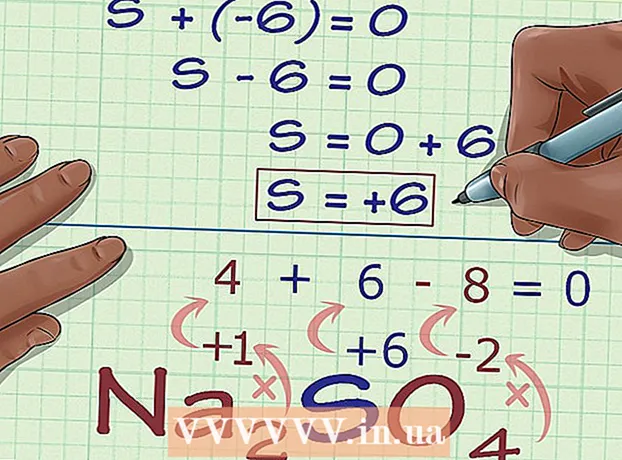
Мундариҷа
- Қадамҳо
- Қисми 1 аз 2: Муайян кардани ҳолати оксидшавӣ тибқи қонунҳои химия
- Қисми 2 аз 2: Муайян кардани ҳолати оксидшавӣ бидуни истифодаи қонунҳои химия
- Маслиҳатҳо
- Ба шумо чӣ лозим
Дар химия истилоҳҳои "оксидшавӣ" ва "коҳиш" реаксияҳоеро ифода мекунанд, ки дар онҳо атом ё гурӯҳи атомҳо мутаносибан электронҳоро аз даст медиҳанд ё ба даст меоранд. Ҳолати оксидшавӣ арзиши ададӣ мебошад, ки ба як ё якчанд атом таъин шудааст, ки шумораи электронҳои аз нав тақсимшударо тавсиф мекунад ва нишон медиҳад, ки ин электронҳо дар давоми як реаксия дар байни атомҳо чӣ гуна тақсим мешаванд. Муайян кардани ин арзиш метавонад вобаста ба атомҳо ва молекулаҳои таркибии онҳо ҳам як тартиби оддӣ ва ҳам хеле мураккаб бошад. Ғайр аз он, атомҳои баъзе элементҳо метавонанд якчанд ҳолати оксидшавӣ дошта бошанд. Хушбахтона, қоидаҳои оддии оддӣ барои муайян кардани ҳолати оксидшавӣ мавҷуданд, ки барои истифодаи боэътимоди онҳо донистани асосҳои химия ва алгебра кифоя аст.
Қадамҳо
Қисми 1 аз 2: Муайян кардани ҳолати оксидшавӣ тибқи қонунҳои химия
 1 Муайян кунед, ки оё моддаи мавриди назар унсур аст. Ҳолати оксидшавии атомҳои берун аз пайвастагии химиявӣ сифр аст. Ин қоида ҳам барои моддаҳое, ки аз атомҳои ҷудогонаи озод ташаккул ёфтаанд ва ҳам барои онҳое, ки аз ду молекулаи полиатомии як элемент иборатанд, дуруст аст.
1 Муайян кунед, ки оё моддаи мавриди назар унсур аст. Ҳолати оксидшавии атомҳои берун аз пайвастагии химиявӣ сифр аст. Ин қоида ҳам барои моддаҳое, ки аз атомҳои ҷудогонаи озод ташаккул ёфтаанд ва ҳам барои онҳое, ки аз ду молекулаи полиатомии як элемент иборатанд, дуруст аст. - Масалан, Ал(с) ва Cl2 ҳолати оксидшавии 0 доранд, зеро ҳарду дар ҳолати элементи аз ҷиҳати химиявӣ номаҳдуд мебошанд.
- Дар хотир доред, ки шакли аллотропии сулфур С.8, ё октацера, сарфи назар аз сохтори атипии худ, инчунин бо ҳолати оксидшавии сифрӣ тавсиф мешавад.
 2 Муайян кунед, ки оё ин модда аз ионҳо иборат аст. Ҳолати оксидшавии ионҳо ба заряди онҳо баробар аст. Ин ҳам барои ионҳои озод ва ҳам барои онҳое, ки ҷузъи пайвастагиҳои химиявӣ мебошанд, дуруст аст.
2 Муайян кунед, ки оё ин модда аз ионҳо иборат аст. Ҳолати оксидшавии ионҳо ба заряди онҳо баробар аст. Ин ҳам барои ионҳои озод ва ҳам барои онҳое, ки ҷузъи пайвастагиҳои химиявӣ мебошанд, дуруст аст. - Масалан, ҳолати оксидшавии Cl иони -1 аст.
- Ҳолати оксидшавии Cl ион дар таркиби химиявии NaCl низ -1 аст. Азбаски иони Na, аз рӯи таъриф, заряди +1 дорад, мо ба хулосае омадем, ки заряди Cl ион -1 аст ва аз ин рӯ ҳолати оксидшавии он -1 аст.
 3 Лутфан таваҷҷӯҳ намоед, ки ионҳои металлӣ метавонанд якчанд ҳолати оксидшавиро дошта бошанд. Атомҳои бисёр унсурҳои металлӣ метавонанд ба миқдори гуногун ионизатсия шаванд. Масалан, заряди иони металл ба монанди оҳан (Fe) +2 ё +3 аст. Заряди ионҳои металлӣ (ва ҳолати оксидшавии онҳо) -ро метавон бо зарядҳои ионҳои унсурҳои дигар, ки ин металл ҷузъи пайвастаи кимиёвист, муайян кардан мумкин аст; дар матн ин заряд бо рақамҳои румӣ ифода карда мешавад: масалан, оҳан (III) дорои ҳолати оксидшавии +3 мебошад.
3 Лутфан таваҷҷӯҳ намоед, ки ионҳои металлӣ метавонанд якчанд ҳолати оксидшавиро дошта бошанд. Атомҳои бисёр унсурҳои металлӣ метавонанд ба миқдори гуногун ионизатсия шаванд. Масалан, заряди иони металл ба монанди оҳан (Fe) +2 ё +3 аст. Заряди ионҳои металлӣ (ва ҳолати оксидшавии онҳо) -ро метавон бо зарядҳои ионҳои унсурҳои дигар, ки ин металл ҷузъи пайвастаи кимиёвист, муайян кардан мумкин аст; дар матн ин заряд бо рақамҳои румӣ ифода карда мешавад: масалан, оҳан (III) дорои ҳолати оксидшавии +3 мебошад. - Ҳамчун намуна, як пайвастагиро дар бар гиред, ки иони алюминий дорад. Нархи умумии пайвастагиҳои AlCl3 сифр аст.Азбаски мо медонем, ки ионҳои Cl заряди -1 доранд ва дар таркиб 3 чунин ион мавҷуд аст, барои бетарафии умумии моддаи мавриди назар, иони Ал бояд заряди +3 дошта бошад. Ҳамин тариқ, дар ин ҳолат ҳолати оксидшавии алюминий +3 аст.
 4 Ҳолати оксидшавии оксиген -2 аст (ба истиснои баъзе ҳолатҳо). Қариб дар ҳама ҳолатҳо, атомҳои оксиген ҳолати оксидшавии -2 доранд. Якчанд истисноҳо аз ин қоида вуҷуд доранд:
4 Ҳолати оксидшавии оксиген -2 аст (ба истиснои баъзе ҳолатҳо). Қариб дар ҳама ҳолатҳо, атомҳои оксиген ҳолати оксидшавии -2 доранд. Якчанд истисноҳо аз ин қоида вуҷуд доранд: - Агар оксиген дар ҳолати элементарӣ бошад (О2), ҳолати оксидшавии он мисли дигар моддаҳои элементарӣ 0 аст.
- Агар оксиген ҷузъи он бошад пероксид, ҳолати оксидшавии он -1 аст. Пероксидҳо як гурӯҳи пайвастагиҳо мебошанд, ки дорои пайванди оддии оксиген-оксиген мебошанд (яъне анион пероксиди О2). Масалан, дар таркиби Ҳ2О2 (пероксиди гидроген) оксиген дорои заряд ва ҳолати оксидшавии -1 мебошад.
- Ҳангоми якҷоя бо фтор, оксиген ҳолати оксидшавии +2 дорад, қоидаи фторро дар зер хонед.
 5 Гидроген дорои ҳолати оксидшавии +1 аст, ба истиснои баъзе ҳолатҳо. Мисли оксиген, истисноҳо низ мавҷуданд. Одатан, ҳолати оксидшавии гидроген +1 аст (агар он дар ҳолати элементи H набошад2). Аммо, дар пайвастагиҳо, ки гидридҳо номида мешаванд, ҳолати оксидшавии гидроген -1 аст.
5 Гидроген дорои ҳолати оксидшавии +1 аст, ба истиснои баъзе ҳолатҳо. Мисли оксиген, истисноҳо низ мавҷуданд. Одатан, ҳолати оксидшавии гидроген +1 аст (агар он дар ҳолати элементи H набошад2). Аммо, дар пайвастагиҳо, ки гидридҳо номида мешаванд, ҳолати оксидшавии гидроген -1 аст. - Масалан, дар Ҳ2О Ҳолати оксидшавии гидроген +1 аст, зеро атоми оксиген заряди -2 дорад ва барои бетарафии умумӣ ду заряди +1 лозим аст. Бо вуҷуди ин, дар таркиби гидриди натрий, ҳолати оксидшавии гидроген аллакай -1 аст, зеро иони Na заряди +1 дорад ва барои электронейтралияти умумӣ заряди атомҳои гидроген (ва ҳамин тавр ҳолати оксидшавии он) бояд бошад -1.
 6 Фтор ҳамеша ҳолати оксидшавии -1 дорад. Тавре ки аллакай қайд карда шуд, ҳолати оксидшавии баъзе элементҳо (ионҳои металлӣ, атомҳои оксиген дар пероксидҳо ва ғайра) вобаста ба як қатор омилҳо метавонанд фарқ кунанд. Ҳолати оксидшавии фтор доимӣ -1 аст. Ин ба он вобаста аст, ки ин унсур дорои бузургтарин қудрати электроэнергетикӣ мебошад - ба ибораи дигар, атомҳои фтор камтарин хоҳиш доранд, ки бо электронҳои худ ҷудо шаванд ва фаъолтарин электронҳои хориҷиро ҷалб кунанд. Ҳамин тариқ, пардохти онҳо бетағйир боқӣ мемонад.
6 Фтор ҳамеша ҳолати оксидшавии -1 дорад. Тавре ки аллакай қайд карда шуд, ҳолати оксидшавии баъзе элементҳо (ионҳои металлӣ, атомҳои оксиген дар пероксидҳо ва ғайра) вобаста ба як қатор омилҳо метавонанд фарқ кунанд. Ҳолати оксидшавии фтор доимӣ -1 аст. Ин ба он вобаста аст, ки ин унсур дорои бузургтарин қудрати электроэнергетикӣ мебошад - ба ибораи дигар, атомҳои фтор камтарин хоҳиш доранд, ки бо электронҳои худ ҷудо шаванд ва фаъолтарин электронҳои хориҷиро ҷалб кунанд. Ҳамин тариқ, пардохти онҳо бетағйир боқӣ мемонад.  7 Ҷамъи ҳолати оксидшавӣ дар таркиб ба заряди он баробар аст. Ҳолатҳои оксидшавии ҳамаи атомҳое, ки як пайвастагии химиявиро ташкил медиҳанд, бояд ба заряди ин пайвастагӣ зам шаванд. Масалан, агар пайвастагӣ нейтрал бошад, ҷамъи ҳолати оксидшавии ҳамаи атомҳои он бояд сифр бошад; агар пайвастагӣ иони полиатомӣ бо заряди -1 бошад, ҷамъи ҳолати оксидшавӣ -1 аст ва ғайра.
7 Ҷамъи ҳолати оксидшавӣ дар таркиб ба заряди он баробар аст. Ҳолатҳои оксидшавии ҳамаи атомҳое, ки як пайвастагии химиявиро ташкил медиҳанд, бояд ба заряди ин пайвастагӣ зам шаванд. Масалан, агар пайвастагӣ нейтрал бошад, ҷамъи ҳолати оксидшавии ҳамаи атомҳои он бояд сифр бошад; агар пайвастагӣ иони полиатомӣ бо заряди -1 бошад, ҷамъи ҳолати оксидшавӣ -1 аст ва ғайра. - Ин як усули хуби озмоиш аст - агар маблағи ҳолати оксидшавӣ ба заряди умумии таркиб баробар набошад, пас шумо дар ҷое иштибоҳ мекунед.
Қисми 2 аз 2: Муайян кардани ҳолати оксидшавӣ бидуни истифодаи қонунҳои химия
 1 Атомҳоеро ёбед, ки дар бораи ҳолати оксидшавии онҳо қоидаҳои қатъӣ надоранд. Барои баъзе унсурҳо қоидаҳои собитшудаи дарёфти ҳолати оксидшавӣ вуҷуд надоранд. Агар атом ба ягон қоидаи дар боло номбаршуда мувофиқат накунад ва шумо заряди онро намедонед (масалан, атом ҷузъи комплекс аст ва заряди он муайян нашудааст), шумо метавонед ҳолати оксидшавии чунин атомро муайян кунед бо истисно. Аввал заряди ҳамаи атомҳои дигари таркибро муайян кунед ва сипас аз заряди умумии умумии таркиб ҳолати оксидшавии ин атомро ҳисоб кунед.
1 Атомҳоеро ёбед, ки дар бораи ҳолати оксидшавии онҳо қоидаҳои қатъӣ надоранд. Барои баъзе унсурҳо қоидаҳои собитшудаи дарёфти ҳолати оксидшавӣ вуҷуд надоранд. Агар атом ба ягон қоидаи дар боло номбаршуда мувофиқат накунад ва шумо заряди онро намедонед (масалан, атом ҷузъи комплекс аст ва заряди он муайян нашудааст), шумо метавонед ҳолати оксидшавии чунин атомро муайян кунед бо истисно. Аввал заряди ҳамаи атомҳои дигари таркибро муайян кунед ва сипас аз заряди умумии умумии таркиб ҳолати оксидшавии ин атомро ҳисоб кунед. - Масалан, дар таркиби Na2СО4 заряди атоми сулфур (S) номаълум аст - мо танҳо медонем, ки он сифр нест, зеро сулфур дар ҳолати элементарӣ нест. Ин пайвастагӣ барои нишон додани усули алгебравии муайян кардани ҳолати оксидшавӣ ҳамчун намунаи хуб хизмат мекунад.
 2 Ҳолати оксидшавии элементҳои боқимондаро дар таркиб пайдо кунед. Бо истифода аз қоидаҳои дар боло тавсифшуда, ҳолати оксидшавии атомҳои боқимондаи таркибро муайян кунед. Дар бораи истисноҳои қоида барои O, H ва ғайра фаромӯш накунед.
2 Ҳолати оксидшавии элементҳои боқимондаро дар таркиб пайдо кунед. Бо истифода аз қоидаҳои дар боло тавсифшуда, ҳолати оксидшавии атомҳои боқимондаи таркибро муайян кунед. Дар бораи истисноҳои қоида барои O, H ва ғайра фаромӯш накунед. - Барои Na2СО4, бо истифода аз қоидаҳои худ, мо мефаҳмем, ки заряд (ва аз ин рӯ ҳолати оксидшавӣ) -и иони Na +1 аст ва барои ҳар як атомҳои оксиген он -2 аст.
 3 Шумораи атомҳоро аз рӯи ҳолати оксидшавии онҳо зарб кунед. Ҳоло, ки мо ҳолати оксидшавии ҳама атомҳоро ба ҷуз як медонем, бояд ба назар гирифт, ки мумкин аст якчанд атомҳои баъзе элементҳо вуҷуд дошта бошанд. Шумораи атомҳои ҳар як унсурро (он дар формулаи химиявии таркиб ҳамчун зергурӯҳи пас аз рамзи элемент нишон дода шудааст) ба ҳолати оксидшавии он зарб кунед.
3 Шумораи атомҳоро аз рӯи ҳолати оксидшавии онҳо зарб кунед. Ҳоло, ки мо ҳолати оксидшавии ҳама атомҳоро ба ҷуз як медонем, бояд ба назар гирифт, ки мумкин аст якчанд атомҳои баъзе элементҳо вуҷуд дошта бошанд. Шумораи атомҳои ҳар як унсурро (он дар формулаи химиявии таркиб ҳамчун зергурӯҳи пас аз рамзи элемент нишон дода шудааст) ба ҳолати оксидшавии он зарб кунед. - Дар На2СО4 мо 2 атомҳои Na ва 4 атом дорем. Ҳамин тариқ, 2 × +1 зарб карда, мо ҳолати оксидшавии ҳамаи атомҳои Na (2) ва зарбҳои 4 × -2 -ҳолати оксидшавии атомҳои O (-8) -ро ба даст меорем.
 4 Натиҷаҳои қаблиро илова кунед. Натиҷаҳои зарбро ҷамъбаст карда, мо ҳолати оксидшавии пайвастаро ба даст меорем бе бо назардошти хиссаи атоми дилхох.
4 Натиҷаҳои қаблиро илова кунед. Натиҷаҳои зарбро ҷамъбаст карда, мо ҳолати оксидшавии пайвастаро ба даст меорем бе бо назардошти хиссаи атоми дилхох. - Дар мисоли мо, барои Na2СО4 мо 2 ва -8 илова мекунем ва -6 мегирем.
 5 Ҳолати оксидшавии номаълумро аз заряди пайвастагӣ пайдо кунед. Ҳоло шумо ҳама маълумотро доред, то ҳолати оксидшавии дилхоҳро ба осонӣ ҳисоб кунед. Як муодилаеро нависед, ки дар тарафи чапи он маблағи адади дар қадами қаблии ҳисоб гирифташуда ва ҳолати оксидшавии номаълум ва дар тарафи рости заряди умумии таркиб мавҷуд бошад. Ба ибораи дигар, (Ҷамъи ҳолати оксидшавии маълум) + (ҳолати оксидшавии дилхоҳ) = (заряди пайвастагӣ).
5 Ҳолати оксидшавии номаълумро аз заряди пайвастагӣ пайдо кунед. Ҳоло шумо ҳама маълумотро доред, то ҳолати оксидшавии дилхоҳро ба осонӣ ҳисоб кунед. Як муодилаеро нависед, ки дар тарафи чапи он маблағи адади дар қадами қаблии ҳисоб гирифташуда ва ҳолати оксидшавии номаълум ва дар тарафи рости заряди умумии таркиб мавҷуд бошад. Ба ибораи дигар, (Ҷамъи ҳолати оксидшавии маълум) + (ҳолати оксидшавии дилхоҳ) = (заряди пайвастагӣ).- Дар ҳолати мо, Na2СО4 ҳалли чунин ба назар мерасад:
- (Ҷамъи ҳолати оксидшавии маълум) + (ҳолати оксидшавии дилхоҳ) = (заряди таркибӣ)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2СО4 сулфур ҳолати оксидшавӣ дорад 6.
- Дар ҳолати мо, Na2СО4 ҳалли чунин ба назар мерасад:
Маслиҳатҳо
- Дар пайвастагиҳо, ҷамъи ҳама ҳолати оксидшавӣ бояд ба заряд баробар бошад. Масалан, агар пайвастагӣ як иони диатомӣ бошад, ҷамъи ҳолати оксидшавии атомҳо бояд ба заряди умумии ионӣ баробар бошад.
- Истифодаи ҷадвали даврӣ ва донистани унсурҳои металлӣ ва ғайриметаллӣ дар он хеле муфид аст.
- Ҳолати оксидшавии атомҳо дар шакли ибтидоӣ ҳамеша сифр аст. Ҳолати оксидшавии як иони ягона ба заряди он баробар аст. Унсурҳои гурӯҳи 1А ҷадвали даврӣ, аз қабили гидроген, литий, натрий дар шакли элементи дорои ҳолати оксидшавии +1 мебошанд; Ҳолати оксидшавии металлҳои гурӯҳи 2А, аз қабили магний ва калсий, дар шакли элементи +2 аст. Оксиген ва гидроген, вобаста аз намуди пайванди химиявӣ, метавонанд 2 ҳолати оксидшавии гуногун дошта бошанд.
Ба шумо чӣ лозим
- Ҷадвали даврии элементҳо
- Маълумотномаҳои дастрасӣ ба интернет ё химия
- Як варақ, қалам ё қалам
- Ҳисобкунак