Муаллиф:
Virginia Floyd
Санаи Таъсис:
6 Август 2021
Навсозӣ:
1 Июл 2024
Мундариҷа
- Қадамҳо
- Усули 1 аз 3: Асосҳо
- Усули 2 аз 3: Муайян кардани намуди пайвандак тавассути электронегативӣ
- Усули 3 аз 3: Ҳисоб кардани электронегативии Mulliken
- Маслиҳатҳо
Дар химия, электронегатсия қобилияти атомҳо барои ҷалби электронҳои дигар атомҳо ба онҳо мебошад. Атоме, ки дорои қувваи электрегативӣ баланд аст, электронҳоро сахт ба худ ҷалб мекунад ва атоме, ки дорои қобилияти пасти электронҳо суст аст. Арзишҳои электронегативӣ барои пешгӯии рафтори атомҳои гуногун дар пайвастагиҳои химиявӣ истифода мешаванд.
Қадамҳо
Усули 1 аз 3: Асосҳо
 1 Вомбаргҳои кимиёвӣ. Чунин пайвандҳо вақте ба вуҷуд меоянд, ки электронҳои атомҳо бо ҳамдигар муошират кунанд, яъне ду электрон (як аз ҳар як атом) умумӣ шаванд.
1 Вомбаргҳои кимиёвӣ. Чунин пайвандҳо вақте ба вуҷуд меоянд, ки электронҳои атомҳо бо ҳамдигар муошират кунанд, яъне ду электрон (як аз ҳар як атом) умумӣ шаванд. - Тавсифи сабабҳои таъсири муштараки электронҳо дар атомҳо аз доираи ин мақола берун аст.Барои гирифтани маълумоти бештар дар бораи ин мавзӯъ, масалан, ин мақоларо хонед.
 2 Таъсири электронегативӣ. Вақте ки ду атом электронҳои якдигарро ҷалб мекунанд, қувваи ҷалб яксон нест. Атоме, ки қобилияти электрегативии баландтар дорад, ду электронро қавитар ҷалб мекунад. Атоме, ки дорои қувваи электрегативии хеле баланд аст, электронҳоро бо чунин қувва ҷалб мекунад, ки мо дигар дар бораи электронҳои муштарак сухан намегӯем.
2 Таъсири электронегативӣ. Вақте ки ду атом электронҳои якдигарро ҷалб мекунанд, қувваи ҷалб яксон нест. Атоме, ки қобилияти электрегативии баландтар дорад, ду электронро қавитар ҷалб мекунад. Атоме, ки дорои қувваи электрегативии хеле баланд аст, электронҳоро бо чунин қувва ҷалб мекунад, ки мо дигар дар бораи электронҳои муштарак сухан намегӯем. - Масалан, дар молекулаи NaCl (хлориди натрий, намаки оддӣ), атоми хлор дорои дараҷаи баланди электрегативӣ аст ва атоми натрий нисбатан паст аст. Пас электронҳо ба атоми хлор ҷалб карда мешаванд ва атомҳои натрийро дафъ кунед.
 3 Ҷадвали электрегативӣ. Ин ҷадвал унсурҳои кимиёвиро дар бар мегирад, ки ҳамон тавре ки дар ҷадвали даврӣ ҷойгир шудаанд, аммо барои ҳар як элемент қувваи электрегатии атомҳои он оварда шудааст. Чунин ҷадвалро дар китобҳои дарсии химия, маводи истинодӣ ва интернет пайдо кардан мумкин аст.
3 Ҷадвали электрегативӣ. Ин ҷадвал унсурҳои кимиёвиро дар бар мегирад, ки ҳамон тавре ки дар ҷадвали даврӣ ҷойгир шудаанд, аммо барои ҳар як элемент қувваи электрегатии атомҳои он оварда шудааст. Чунин ҷадвалро дар китобҳои дарсии химия, маводи истинодӣ ва интернет пайдо кардан мумкин аст. - Шумо дар ин ҷо як ҷадвали аълои электрегатсияро хоҳед ёфт. Аҳамият диҳед, ки он миқёси электронегативии Полингро истифода мебарад, ки маъмултарин аст. Бо вуҷуди ин, роҳҳои дигари ҳисоб кардани электрегатсия вуҷуд доранд, ки яке аз онҳо дар зер баррасӣ хоҳад шуд.
 4 Тамоюлҳои электроэнергетикӣ. Агар шумо ҷадвали электроэнергияро дар даст надошта бошед, шумо метавонед қобилияти электрегатии атомро аз рӯи ҷойгиршавии элемент дар ҷадвали даврӣ арзёбӣ кунед.
4 Тамоюлҳои электроэнергетикӣ. Агар шумо ҷадвали электроэнергияро дар даст надошта бошед, шумо метавонед қобилияти электрегатии атомро аз рӯи ҷойгиршавии элемент дар ҷадвали даврӣ арзёбӣ кунед. - Чӣ хел Ба тарафи рост элемент ҷойгир аст, Бештар қувваи электрегатии атоми он.
- Чӣ хел баландтар элемент ҷойгир аст, Бештар қобилияти электронии атомаш.
- Ҳамин тариқ, атомҳои унсурҳое, ки дар кунҷи рости болоии ҷадвали даврӣ ҷойгиранд, дорои энергияи баландтарин ва атомҳои унсурҳои дар кунҷи чапи поёни пасттарин мебошанд.
- Дар мисоли NaCl -и худ, мо гуфта метавонем, ки хлор нисбат ба натрий қудрати баландтар дорад, зеро хлор дар тарафи рости натрий ҷойгир аст.
Усули 2 аз 3: Муайян кардани намуди пайвандак тавассути электронегативӣ
 1 Барои фаҳмидани хусусиятҳои пайванди байни онҳо фарқи байни электронегативии ду атомро ҳисоб кунед. Барои ин кор, электронегативии хурдтарро аз калонтар хориҷ кунед.
1 Барои фаҳмидани хусусиятҳои пайванди байни онҳо фарқи байни электронегативии ду атомро ҳисоб кунед. Барои ин кор, электронегативии хурдтарро аз калонтар хориҷ кунед. - Масалан, молекулаи HF -ро баррасӣ кунед. Электронегативии гидроген (2.1) -ро аз электронегативии фтор (4.0) хориҷ кунед: 4.0 - 2.1 = 1,9.
 2 Агар фарқият аз 0,5 камтар бошад, он гоҳ пайвандак ковалентии ғайри қутбӣ аст, ки дар он электронҳо тақрибан бо ҳамон қувва ҷалб карда мешаванд. Чунин пайвандҳо байни ду атомҳои якхела ба вуҷуд меоянд. Пайвастҳои ғайри қутбӣ умуман канда шудан хеле душвор аст. Сабаб дар он аст, ки атомҳо электронҳоро тақсим мекунанд, ки пайванди онҳоро устувор месозад. Барои нест кардани он нерӯи зиёд лозим аст.
2 Агар фарқият аз 0,5 камтар бошад, он гоҳ пайвандак ковалентии ғайри қутбӣ аст, ки дар он электронҳо тақрибан бо ҳамон қувва ҷалб карда мешаванд. Чунин пайвандҳо байни ду атомҳои якхела ба вуҷуд меоянд. Пайвастҳои ғайри қутбӣ умуман канда шудан хеле душвор аст. Сабаб дар он аст, ки атомҳо электронҳоро тақсим мекунанд, ки пайванди онҳоро устувор месозад. Барои нест кардани он нерӯи зиёд лозим аст. - Масалан, молекулаи О2 ин намуди пайвастшавӣ дорад. Азбаски ду атом оксиген якхелаи электрегативӣ доранд, фарқи байни онҳо 0 аст.
 3 Агар фарқият дар ҳудуди 0,5 - 1,6 бошад, пас пайванд қутби ковалентӣ аст. Дар ин ҳолат, яке аз ду атом электронҳоро қавитар ҷалб мекунад ва аз ин рӯ қисман заряди манфӣ ва дигаре заряди мусбатро ба даст меорад. Ин нобаробарии зарядҳо ба молекула имкон медиҳад, ки дар аксуламалҳои муайян иштирок кунад.
3 Агар фарқият дар ҳудуди 0,5 - 1,6 бошад, пас пайванд қутби ковалентӣ аст. Дар ин ҳолат, яке аз ду атом электронҳоро қавитар ҷалб мекунад ва аз ин рӯ қисман заряди манфӣ ва дигаре заряди мусбатро ба даст меорад. Ин нобаробарии зарядҳо ба молекула имкон медиҳад, ки дар аксуламалҳои муайян иштирок кунад. - Масалан, молекулаи H2O (об) ин намуди пайвандак дорад. Атоми О нисбат ба ду атоми Н бештар электронегативӣ аст, аз ин рӯ оксиген электронҳоро қавитар ҷалб мекунад ва заряди қисман манфӣ ва гидроген - заряди қисман мусбатро ба даст меорад.
 4 Агар фарқият аз 2.0 зиёдтар бошад, пас пайванд ион аст. Ин пайвандакест, ки дар он ҷуфти электронии умумӣ асосан ба атоме мегузарад, ки дорои қобилияти баландтари электронегативӣ аст, ки заряди манфӣ ба даст меорад ва атоме, ки қобилияти пасттараш заряди мусбат дорад. Молекулаҳо бо чунин пайвандҳо бо дигар атомҳо хуб муносибат мекунанд ва ҳатто метавонанд бо атомҳои қутбӣ нобуд шаванд.
4 Агар фарқият аз 2.0 зиёдтар бошад, пас пайванд ион аст. Ин пайвандакест, ки дар он ҷуфти электронии умумӣ асосан ба атоме мегузарад, ки дорои қобилияти баландтари электронегативӣ аст, ки заряди манфӣ ба даст меорад ва атоме, ки қобилияти пасттараш заряди мусбат дорад. Молекулаҳо бо чунин пайвандҳо бо дигар атомҳо хуб муносибат мекунанд ва ҳатто метавонанд бо атомҳои қутбӣ нобуд шаванд. - Масалан, молекулаи NaCl (хлориди натрий) ин гуна пайвандак дорад.Атоми хлор он қадар электронегативӣ аст, ки ҳарду электронро ба худ ҷалб мекунад ва заряди манфӣ ба даст меорад ва атоми натрий заряди мусбат ба даст меорад.
- NaCl метавонад бо молекулаи қутбӣ ба монанди H2O (об) нобуд карда шавад. Дар як молекулаи об, ҷониби гидрогении молекула мусбат ва ҷониби оксиген манфӣ аст. Агар шумо намакро бо об омехта кунед, молекулаҳои об молекулаҳои намакро вайрон мекунанд ва боиси пароканда шудани он мешаванд.
 5 Агар фарқият байни 1.6 ва 2.0 бошад, металлро тафтиш кунед. Агар як атоми металлӣ дар молекула мавҷуд бошад, пас пайванди ионӣ аст. Агар дар молекула атомҳои металлӣ набошанд, пас пайванд коваленти қутбӣ аст.
5 Агар фарқият байни 1.6 ва 2.0 бошад, металлро тафтиш кунед. Агар як атоми металлӣ дар молекула мавҷуд бошад, пас пайванди ионӣ аст. Агар дар молекула атомҳои металлӣ набошанд, пас пайванд коваленти қутбӣ аст. - Металҳо дар тарафи чап ва дар маркази ҷадвали даврӣ ҷойгиранд. Дар ин ҷадвал металлҳо равшан карда шудаанд.
- Дар мисоли HF -и мо, фарқи байни электронегативӣ ба ин диапазон рост меояд. Азбаски H ва F металл нестанд, пайванд ковалентии қутбӣ.
Усули 3 аз 3: Ҳисоб кардани электронегативии Mulliken
 1 Аввалин энергияи ионизатсияи атомро ёбед. Ҷадвали электроэнергетикии Мулликен аз миқёси Полинги дар боло зикршуда каме фарқ мекунад. Аввалин энергияи ионизатсия барои хориҷ кардани як атом аз электрон лозим аст.
1 Аввалин энергияи ионизатсияи атомро ёбед. Ҷадвали электроэнергетикии Мулликен аз миқёси Полинги дар боло зикршуда каме фарқ мекунад. Аввалин энергияи ионизатсия барои хориҷ кардани як атом аз электрон лозим аст. - Маънои ин гуна энергияро дар маълумотномаҳои химия ё дар шабака пайдо кардан мумкин аст, масалан, дар ин ҷо.
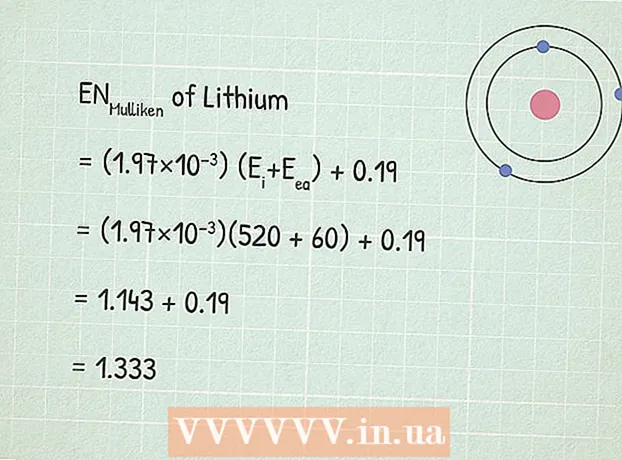
- Ҳамчун намуна, биёед қобилияти электрогенитии литий (Li) -ро пайдо кунем. Аввалин энергияи ионизатсияи он аст 520 кДж / мол.
 2 Энергияи наздикии электронро ёбед. Ин энергияест, ки дар ҷараёни пайваст кардани электрон ба атом ҷудо мешавад. Маънои ин гуна энергияро дар маълумотномаҳои химия ё дар шабака пайдо кардан мумкин аст, масалан, дар ин ҷо.
2 Энергияи наздикии электронро ёбед. Ин энергияест, ки дар ҷараёни пайваст кардани электрон ба атом ҷудо мешавад. Маънои ин гуна энергияро дар маълумотномаҳои химия ё дар шабака пайдо кардан мумкин аст, масалан, дар ин ҷо. - Энергияи наздикии электронҳои литий аст 60 кДж / мол.
 3 Истифодаи муодилаи электроэнергетикии Мулликен:RUМулликен = (1.97 × 10) (E.ман+ Ееа) + 0,19.
3 Истифодаи муодилаи электроэнергетикии Мулликен:RUМулликен = (1.97 × 10) (E.ман+ Ееа) + 0,19. - Дар мисоли мо:
- RUМулликен = (1.97 × 10) (E.ман+ Ееа) + 0,19
- RUМулликен = (1,97×10)(520 + 60) + 0,19
- RUМулликен = 1,143 + 0,19 = 1,333
- Дар мисоли мо:
Маслиҳатҳо
- Илова ба тарозуи Полинг ва Мулликен, тарозуи электрогенитивӣ мувофиқи Аллред-Рохов, Сандерсон, Аллен мавҷуданд. Ҳама формулаҳои худро барои ҳисоб кардани электрегатсия доранд (баъзеи онҳо хеле мураккабанд).
- Электронегативӣ ягон воҳиди ченак надорад.



